DNA-Reparatur und essentielle Spurenelemente
Der Träger der gesamten genetischen Erbinformation eines Organismus, die DNA, ist der ständigen Gefahr ausgesetzt, durch exogene und endogene Faktoren geschädigt zu werden. Exogene Quellen sind dabei ionisierende Strahlung, Ultraviolett (UV)-Strahlung sowie eine Reihe von genotoxischen Substanzen. Auch reaktive Sauerstoffspezies (ROS) wie Hyperoxidanionen, Hydroxylradikale und Wasserstoffperoxid (H2O2) können Schäden an der DNA verursachen. Endogene DNA-Schäden können in der Zelle spontan auftreten, z.B. durch Desaminierung, Oxidation der Basen sowie Methylierung. Um die Stabilität der genetischen Information dennoch zu gewährleisten, muss ein leistungsfähiges Reparatursystem aufrechterhalten werden. Die Zelle greift dabei, je nach Art des entstandenen Schadens, auf unterschiedliche Reparaturmechanismen zurück.
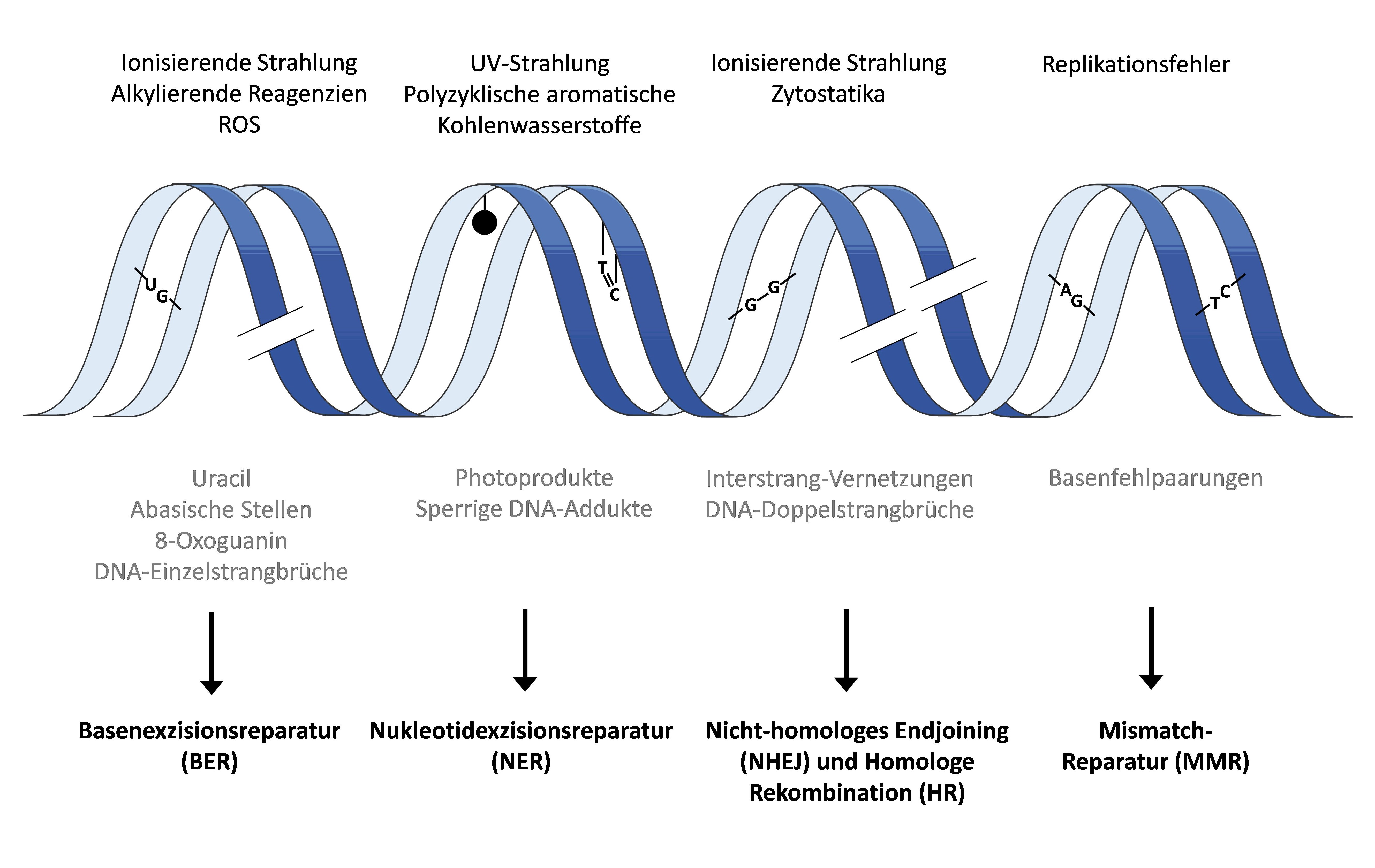
Kleinere DNA-Basenschäden, wie die Oxidation von DNA-Basen und DNA-Strangbrüche werden durch die Basenexzisionsreparatur (BER) und die DNA-Einzelstrangbruchreparatur (SSBR) entfernt. Die Beseitigung sperriger DNA-Veränderungen, wie Pyrimidindimere, erfolgt über die Nukleotidexzisionsreparatur (NER). DNA-Doppelstrangbrüche werden durch das Nicht-homologe Endjoining (NHEJ) und die Homologe Rekombination (HR) repariert. Für die Beseitigung von DNA-Replikationsfehlern ist das System der Mismatch-Reparatur (MMR) verantwortlich.
Jede Störung in einem dieser Mechanismen führt zu unreparierten oder unzureichend reparierten Schäden, die wiederum zu Mutationen, Transkriptions- und Replikationsinhibition, Apoptose, Nekrose, Mutationen, chromosomalen Aberrationen, sowie zum Verlust der Zellteilungskontrolle (Krebs) und zu Missbildungen beim Embryo (Teratogenese) führen können.
Die Effektivität der vorhandenen Reparaturmechanismen ist daher für die Aufrechterhaltung der genomischen Stabilität von entscheidender Bedeutung. Dabei spielen unter anderem die DNA Reparaturproteine PARP-1 (Poly(ADP-Ribose)-Polymerase 1) oder BRCA1 (Breast Cancer 1) entscheidende Rollen. Beide Proteine besitzen Zink-bindende Strukturen, die jedoch auch potentielle Angriffspunkte für toxische Metallionen bzw. (Halb-)Metallverbindungen wie solche von anorganischem Arsen und Cadmium darstellen, und deren Funktion damit beeinträchtig werden kann. Zink ist daher als essentielles Spurenelement wesentlich an der Aufrechterhaltung der genomischen Stabilität beteiligt. Bei hohen Konzentrationen jedoch, wie sie möglicherweise durch Nahrungsergänzungsmittel erreicht werden, können allerdings auch für dieses Metall toxische Reaktionen nicht ausgeschlossen werden. Die oftmals enge Verknüpfung zwischen essentieller und toxischer Wirkung wird bei Spurenelementen wie Kupfer und Eisen besonders deutlich. Während die essentielle biologische Funktion darin besteht, Ein-Elektronen-Übergänge zu katalysieren, kann genau diese Fähigkeit aber auch zu toxischen Reaktionen führen, indem die Generierung reaktiver Sauerstoffspezies katalysiert wird, die in der Folge zelluläre Makromoleküle schädigen können. Somit ist eine genaue Regulation der Metallionenkonzentrationen in Geweben und Zellen nötig, um toxische Effekte zu verhindern; dies wird durch eine strikte Kontrolle der Aufnahme und der intrazellulären Speicherung erreicht. Toxische Wirkungen kommen dann zustande, wenn diese homöostatische Kontrolle entweder durch zu hohe Konzentrationen, durch Aufnahme-oder Speicherdefekte oder durch unphysiologische Aufnahmewege außer Kraft gesetzt wird. Außerdem hängt die biochemische Wirkung auch entscheidend von der Spezies ab, in der das jeweilige Element beispielsweise als Nahrungsergänzungsmittel angeboten wird. Drei Spurenelemente wurden in unserer Gruppe im Detail untersucht: Selen, Kupfer und Zink. Im Fall von Selen konnten wir zeigen, dass die zellulären Effekte entscheidend von der Selenspezies und insbesondere der Oxidationsstufe abhängen. Während vollständig reduzierte Selenverbindungen überwiegend nicht cytotoxisch sind, können reduzierbare Selenverbindungen wie Natriumselenit beispielweise Zink-komplexierende Thiolgruppen oxidieren und zu Hemmungen von DNA-Reparaturprozessen und Tumorsuppressorfunktionen führen. Im Fall von Kupfer findet eine Hemmung der Poly(ADP-Ribosyl)ierung und der Basen-Exzisionsreparatur bei zellulärer Kupferüberladung statt; zudem führen Kupferionen wie auch kupferhaltige Nanopartikel zu ausgeprägten zellulären Stressreaktionen. Insgesamt kommt es bei den Spurenelementen Kupfer, Selen und Zink auf eine Balance zwischen ausreichender Aufnahme und der Vermeidung von Überversorgung an, so dass eine Beeinträchtigung der genomischen Stabilität verhindert wird. Im Rahmen derzeitiger Forschungsprojekte werden Selen und Kupfer nun weitergehend untersucht.
