Methodenspektrum
In unserem Labor wurde ein breites Spektrum an Methoden etabliert, um die Beeinflussung der genomischen Stabilität durch Metalle und Metallverbindungen, Nanomaterialien sowie bioaktive Lebensmittelinhaltsstoffe überwiegend in Zellkulturen zu untersuchen. Sie umfassen:
- Einsatz von klassischen, Cokultur- und 3D-Zellkultursystemen
- Bestimmung der Viabilität und Zytotoxizität,
- Untersuchung von Apoptose und Zellzykluskontrolle (z.B. mittels Durchflusszytometrie),
- Konzentrationsbestimmung relevanter Metalle durch Atomabsorptionsspektrometrie (AAS) und kolorimetrische Methoden,
- qualitative und quantitative Proteinbestimmung durch Western Blot, Immunfluoreszenz und ELISA,
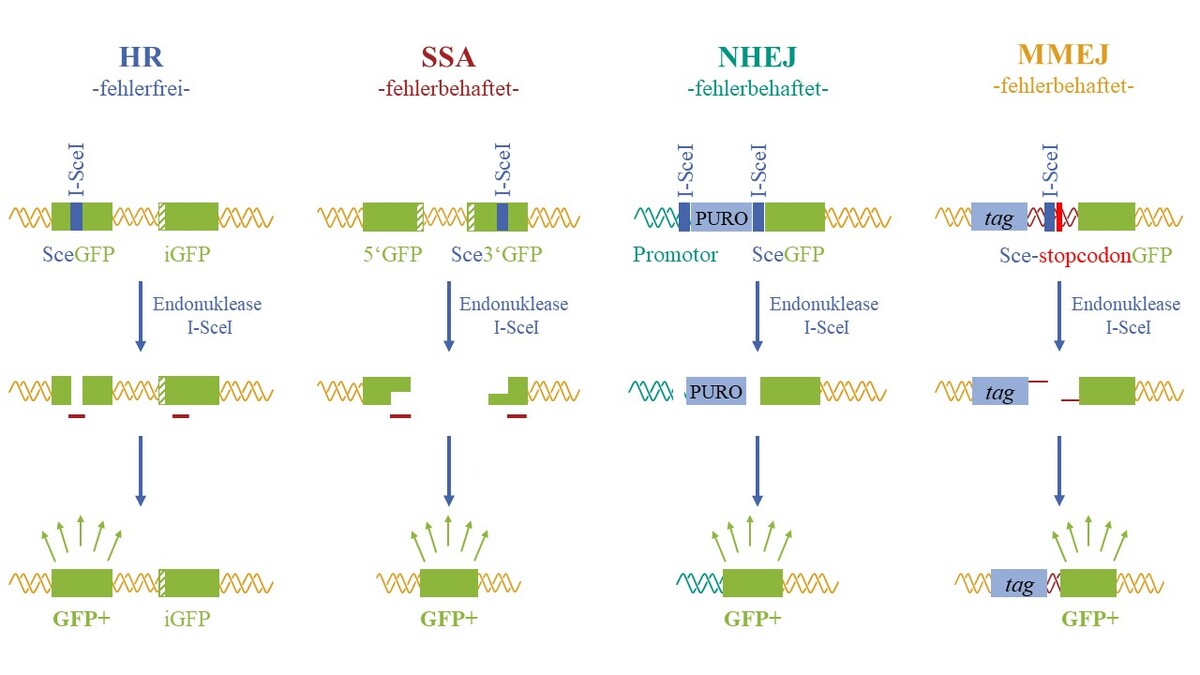
- Quantifizierung der Induktion und Reparatur von DNA-Schäden sowie Mutagenität
- oxidative DNA-Schäden, Benzo[a]pyren-induzierte DNA-Schäden, UVC-induzierte DNA-Schäden, DNA-Einzel- und Doppelstrangbrüche, z.B. durch Alkaline Unwinding, Mikrokern-Test, HPLC mit Fluoreszenzdetektion,
- Untersuchungen unterschiedlicher DNA-Reparatur-Wege (z.B. mithilfe von Reporter-Testsystemen, Reparatur-defizienten Zelllinien, Anlagerung von DNA-Reparaturproteinen),
- Untersuchung der PARP-Aktivität,
- Bestimmung der Mutagenität mittels PIG-A-Assay,
- Zeitaufgelöste Beobachtung ausgewählter Zellabläufe durch Live cell imaging
- Analyse von Genexpressionsprofilen durch real-time RT-PCR sowie Multiplex-PCR
- Einfluss auf die genomische Stabilität (oxidativer Stress, generelle Stressantwort, DNA-Schadensantwort, Zellzykluskontrolle, Metallhomöostase, inflammatorische und fibrotische Zellreaktionen)
- Untersuchung von partikulären und faserförmigen Nanomaterialien
- Charakterisierung von Nanomaterialien (DLS),
- Exposition über ein air-liquid interface,
- Vergleich entsprechender wasserlöslicher Verbindungen mit nano- und mikroskaliger Partikel und faserförmiger Verbindungen hinsichtlich Zytotoxizität, DNA-Schäden, Genexpressionsprofile und weiterer Endpunkte.